Das Element ist unverzichtbar für Pflanzen und Tiere. Kalium (K) ist ein chemisches Element der Gruppe 1 (Ia) des Periodensystems, der Alkalimetallgruppe. Kalium war das erste Metall, das der englische Chemiker Sir Humphry Davy durch Elektrolyse isoliert hatte, als er das Element (1807) durch Zersetzung von geschmolzenem Kaliumhydroxid (KOH) mit einer Batterie erhielt. Das Element ist in der Natur weit verbreitet und steht, was die Häufigkeit betrifft an 7. Stelle.
Das Element ist unverzichtbar für Pflanzen und Tiere. Kalium (K) ist ein chemisches Element der Gruppe 1 (Ia) des Periodensystems, der Alkalimetallgruppe. Kalium war das erste Metall, das der englische Chemiker Sir Humphry Davy durch Elektrolyse isoliert hatte, als er das Element (1807) durch Zersetzung von geschmolzenem Kaliumhydroxid (KOH) mit einer Batterie erhielt. Das Element ist in der Natur weit verbreitet und steht, was die Häufigkeit betrifft an 7. Stelle.
Natrium-Kalium Pumpe
Kalium ist ein lebenswichtiger Mineralstoff für Lebewesen. Als Elektrolyt beeinflusst es die Nervensteuerung beim Menschen. Das Element wird über den Stoffwechsel intrazellulär angereichert. Etwa 98% des Gesamtkaliums befinden sich in den Zellen. Im Lehrunterricht ist die Natrium-Kalium Pumpe ein Begriff. Die Leitung elektrischer Impulse erfolgt unter anderem über Änderungen der Leitfähigkeit der Zellmembran, bei der K-Ionen eine entscheidende Rolle spielen.
Jedes Tier hat einen eng gehaltenen Kaliumspiegel und ein relativ festes Kalium-Natrium-Verhältnis. Kalium ist das primäre anorganische Kation in der lebenden Zelle, und Natrium ist das am häufigsten vorkommende Kation in extrazellulären Flüssigkeiten. Bei höheren Tieren wirken selektive Komplexbildner für Na + und K + an den Zellmembranen für einen “aktiven Transport”. Dieser aktive Transport überträgt elektrochemische Impulse in Nerven- und Muskelfasern sowie einen Ausgleich zwischen der Nährstoffaufnahme und der Abfallbeseitigung aus Zellen.
Pflanzen brauchen es zur Photosynthese, zur Regulierung von Osmose und Wachstum sowie zur Enzymaktivierung. Zu wenig oder zu viel Kalium im Körper ist tödlich. Kalium im Boden sorgt jedoch dafür, dass dieses unverzichtbare Element in Lebensmitteln vorhanden ist.
Vorkommen
Das Meerwasser enthält etwa 0,07% Kaliumchlorid und 98% davon müssen verdampft werden, damit die Kaliumsalze anfangen zu kristallisieren. Kalium ist in vielen Vulkangesteinen zu finden, die durch Zerfall das Element den Böden und dem Wasser zuführen. Das Silikat Leucit und Glaukonit sind die kommerziellen Kaliumquellen. Die Tone können Kalium absorbieren, wodurch es im Boden verbleibt und die Pflanzen es nutzen können. Die wichtigsten Kaliumerze sind: der Sylvin (KCl), der Carnallit (KMgCl₃·6H₂O), der Langbeinit (K₂Mg₂[SO₄]₃) und der Polyhalit (K₂Ca₂Mg[SO₄]₄·2H₂O).
Kalium Isotope
Von dem Element gibt es 3 langlebige Isotope, Kalium-39, Kalium-40 und Kalium-41. Während das K-40 ist radioaktiv ist, sind die beiden anderen Isotope stabil. Zusätzlich existieren weitere 22 radioaktive Isotope, die aber alle eine kurze Halbwertszeit haben.
Anteile
Das natürlicherweise in der Umwelt existierende Kalium besteht mit einem Anteil 93,258% überwiegend aus dem Kalium-39. Das Kalium-41 hat einen Anteil von 6,73% und verbleibend 0,012% aus K-40.
Herstellung
Kalium wird durch Natriumreduktion von geschmolzenem Kaliumchlorid (KCl) bei 870 ° hergestellt. Geschmolzenes KCl wird kontinuierlich in eine Destillationskolonne eingespeist, während Natriumdampf durch die Apparatur geleitet wird. Durch Kondensation des flüchtigeren Kaliums am Kopf des Destillationsturms wird die Reaktion Na + KCl → K + NaCl nach rechts verschoben. Bemühungen, ein Prozess für die kommerzielle elektrolytische Herstellung von Kalium zu entwickeln, waren erfolglos, da es wenige Salzzusätze gibt, die den Schmelzpunkt von Kaliumchlorid auf Temperaturen reduzieren können, bei denen die Elektrolyse effizient ist.
Eigenschaften
Hier sind einige wichtige Kennzahlen angegeben:
| Ordnungszahl | 19 |
| Atomgewicht | 39,098 |
| Schmelzpunkt | 63,28 ° C (145,90 ° F) |
| Siedepunkt | 760 ° C (1.400 ° F) |
| spezifisches Gewicht | 0,862 (bei 20 ° C oder 68 ° F) |
| Oxidationsstufen | +1, -1 (selten) |
| Elektronenkonfiguration | 2-8-8-1 oder 1s22s22p63s23p64s1 |
Verhalten in Pflanzen
Nach Strasburger (2008) ist Kalium das einzige einwertige, positiv geladene Ion, das für alle Pflanzen lebensnotwendig ist. Bei höheren Pflanzen stellt Kalium, von allen Makroelementen oft den höchsten Anteil an der Trockensubstanz (Boresch 1935). Es wirkt insbesondere als Osmotikum bei der Quellung des Zellplasmas und als Co-Faktor bei Enzymreaktionen. Kalium wird in der Pflanzenzelle nicht in organische Verbindungen eingebaut, es liegt fast ausschließlich im Zellsaft und im Quellungswasser von Plasma und Zellwand vor (Schmalfuss 1936).
Wieviel Kalium enthält der menschliche Körper?
Der menschliche Körper behält eine relativ strenge homöostatische Kontrolle über den Kaliumspiegel bei. Dies bedeutet, dass der Konsum von Lebensmitteln, die große Mengen an Kalium enthalten, den Kaliumgehalt des Körpers nicht erhöht.
Der Kaliumgehalt des Menschen ist von dem Geschlecht, Alter und Stoffwechselzustand abhängig. Trotzdem wird in der Medizin mit durchschnittlichen Werten gerechnet. Laut Schmidt und Thews (1995) enthält der menschliche Organismus im Gesamtkörper eine Kaliummenge von 60 mmol/kg. Da 1 mmol 39,1 mg Kalium entsprechen, befinden sich in 1 kg 2,346 g Kalium.
Bestimmung des Gesamtkörper Kaliums
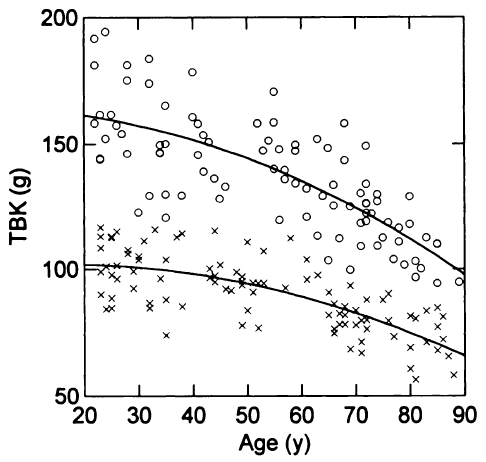
In einer Studie zur Bestimmung des Gesamtkörper Kaliums und des Körperfetts als Funktion des Lebensalters stellten Kehayias et al. 1997 die in Abbildung 2 dargestellten Zusammenhänge fest. Dabei wurde durch Ganzkörpermessung von 188 Probanden die K-40 Aktivität bestimmt und daraus der Kaliumgehalt berechnet.
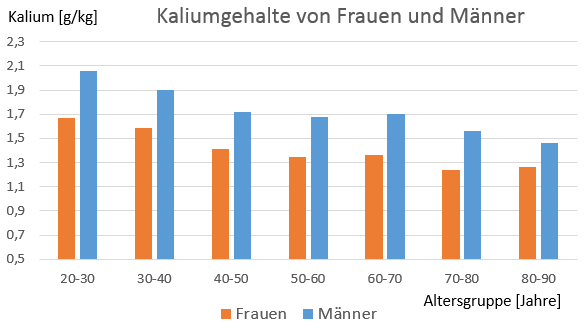
Abb. 1: Kaliumgehalt von Frauen (orange) und Männer (blau) in Gramm pro Kilogramm Körpergewicht nach Altersklassen (n=188). Quelle: Kehayias et al. 1997.
Die Daten dazu sind in der Tabelle 1 angegeben.
Tab. 1: Kalium in Gramm pro Kilogramm Körpergewicht von Männern und Frauen. Quelle: Kehayias et al. 1997.
| Altersgruppe | Frauen | Männer |
| Jahre | Kalium [g/kg] | Kalium [g/kg] |
| 20-30 | 1,67 | 2,06 |
| 30-40 | 1,59 | 1,90 |
| 40-50 | 1,41 | 1,72 |
| 50-60 | 1,35 | 1,68 |
| 60-70 | 1,36 | 1,70 |
| 70-80 | 1,24 | 1,56 |
| 80-90 | 1,26 | 1,46 |
In der Schweiz untersucht das Bundesamt für Gesundheit (BAG) seit Jahrzehnten Personen auf Radiocäsium mittel Ganzkörpermessung. Dabei wird auch die K-40 Gesamtaktivität mit bestimmt. Von 1974 bis 2015 wurden die Aktivitäten von 720 jungen Frauen und 722 jungen Männern gemessen und daraus der Kalium-Gehalt bestimmt.
Bei den Frauen betrug der Kalium-Gehalt im Mittel 1,83 g pro kg Körpergewicht (20 – 80 %-Perzentile: 1.64 – 2.04 g K).
Bei den Männern wurden durchschnittlich 2,29 g K pro kg Körpergewicht (20 – 80%-Perzentile: 2.10 – 2.50 g K) berechnet. Da Männer einen höheren Muskelanteil als Frauen haben, ist das Ergebnis plausibel, denn Kalium kommt besonders häufig im Muskelgewebe vor. Quelle: Bundesamt für Gesundheit BAG der Schweiz.
Bedarf des Menschen
Wieviel Kalium benötigt der Mensch pro Tag? Die Deutsche Gesellschaft für Ernährung e. V. (DGE) geht von den in der Tabelle 2 angegebenen Schätzwerten aus. Danach sollten Erwachsene etwa 4000 mg pro Tag zu sich nehmen.
Tab. 2: Schätzwerte des täglichen angemessenen Kaliumbedarfs/Kaliumzufuhr für verschiedene Alters- bzw. Personengruppen. Quelle: DGE
| Alter | Kalium |
| (mg/Tag) | |
| Säuglinge | |
| 0 bis unter 4 Monate | 400 |
| 4 bis unter 12 Monate | 600 |
| Kinder und Jugendliche | |
| 1 bis unter 4 Jahre | 1.100 |
| 4 bis unter 7 Jahre | 1.300 |
| 7 bis unter 10 Jahre | 2.000 |
| 10 bis unter 13 Jahre | 2.900 |
| 13 bis unter 15 Jahre | 3.600 |
| 15 bis unter 19 Jahre | 4.000 |
| Erwachsene | |
| 19 bis unter 25 Jahre | 4.000 |
| 25 bis unter 51 Jahre | 4.000 |
| 65 Jahre und älter | 4.000 |
| Schwangere | 4.000 |
| Stillende | 4.400 |
Die geschätzten Werte für die Kaliumzufuhr sind auf 400 mg/Tag für gestillte Säuglinge im Alter von 0 bis unter 4 Monaten, 600 mg/Tag für Säuglinge im Alter von 4 bis unter 12 Monaten, 1100-4.000 mg/Tag für Kinder und Jugendliche, 4.000 mg/Tag für Erwachsene und schwangere Frauen festgelegt. 4.400 mg/Tag werden für stillende Frauen empfholen.
Die DGE empfiehlt eine Erhöhung des Verbrauchs von kaliumreichen Lebensmitteln. Aber auch: Eine zusätzliche Einnahme über die geschätzten Werte hinaus hat keinen gesundheitlichen Nutzen und wird daher nicht empfohlen.
Umrechnung mmol in mg
In der Literatur werden oft Angaben in mmol Kalium veröffentlicht. Die Umrechnung in mg ist einfach. Die Formel lautet:
39,1 mg Kalium = 1 mmol Kalium
Total Body Potassium (TBK) – Gesamtkörperkalium
In der Wissenschaft wird das “Gesamtkörperkalium” oft mit dem englischen Term TBK angegeben. Gemeint ist damit Total Body Potassium, also das gesamte im Körper vorhandene Kalium. Die Abbildung 2 zeigt die Entwicklung des Kaliumgehaltes für Frauen und Männer als Funktion des Lebensalters, nach einer Untersuchung an 96 Frauen und 92 Männer in den USA.
Abb. 2: Soviel Kalium enthält der Körper von Frauen und Männer je nach Alter. Die Kurven stellen einen quadratischen Fit dar. Quelle: Kehayias et al. 1997.
Kalium in Boden & Gestein
Wie ist das Element in Böden verteilt? Aufgrund unterschiedlicher Boden- und Gesteinsarten ist die Variabilität mit der Kalium in Böden vorkommt hoch. Dies gilt für Deutschland wie auch für Europa.
Sobald K durch Verwitterung von Feldspatmineralien freigesetzt wird, ist es sehr löslich und tritt als einfaches Kation K + über das gesamte Stabilitätsfeld von natürlichem Wasser auf (Brookins 1988). Obwohl K ein häufig vorkommendes Element ist, ist seine Beweglichkeit durch drei Prozesse begrenzt:
(a) es wird aufgrund seiner Größe leicht in Ton-Mineral-Gitter eingebaut;
(b) es wird stärker als Na + auf den Oberflächen von Tonmineralien und organischen Stoffen adsorbiert; und
(c) es ist ein wichtiges Element in der Biosphäre und wird von wachsenden Pflanzen leicht aufgenommen. Infolgedessen sind K-Konzentrationen von mehr als einigen zehn mg/l ungewöhnlich.
Düngemittel sind die wichtigste anthropogene Kaliumquelle. Viele K-Salze haben wichtige chemische und medizinische Anwendungen, einschließlich Hydroxid, Nitrat, Carbonat, Chlorid, Chlorat, Bromid, Iodid, Cyanid, Sulfat, Chromat und Dichromat. Natürliche Quellen gelten in der Umwelt jedoch als weitaus wichtiger als anthropogene Einträge.
Bodengesundheit
Kalium ist von großer Bedeutung für die Bodengesundheit, das Pflanzenwachstum und die Tierernährung. Seine Hauptfunktion in Pflanzen besteht in der Aufrechterhaltung des osmotischen Drucks und der Zellgröße, wodurch die Photosynthese und die Energieerzeugung beeinflusst werden. Sehr hohe K+-Gehalte im Bodenwasser können jedoch Keimlinge schädigen, die Aufnahme anderer Mineralien hemmen und die Qualität der Kulturpflanzen verringern.
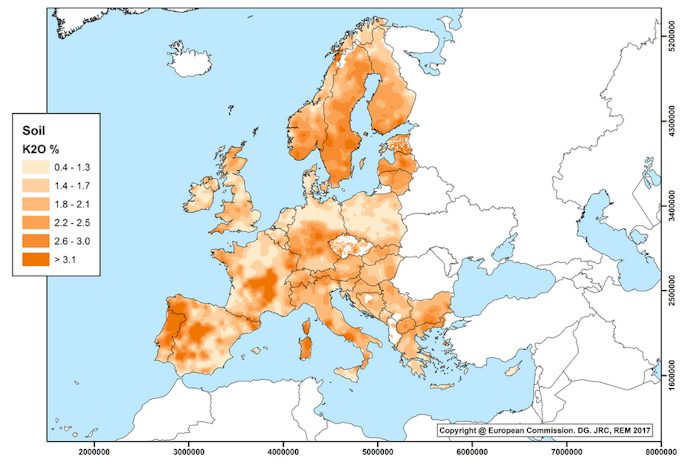
Karte der Kaliumkonzentration (Kaliumoxid (K2O) ) von Europa – Atlas der Verteilung in Böden
Die Gruppe Radioactivity Environmental Monitoring (REM) der Gemeinsamen Forschungsstelle (JRC) der Europäischen Kommission stellt der Öffentlichkeit, den Mitgliedstaaten, der Europäischen Kommission und dem Europäischen Parlament qualifizierte Informationen über den Grad der Umweltradioaktivität zur Verfügung. Für verschiedene Elemente wurden aus Datenbanken Karten erstellt, so auch zum Kalium Gehalt der Böden.
Die Kaliumkonzentration in der Bodenkarte der Abbildung 3 zeigt das arithmetische Mittel der Konzentration von Kaliumoxid (K2O) in Böden über 10 × 10 km Gitterzellen in Europa. Die Karte wurde aus ungefähr 5000 Daten von Oberbodenproben von zwei europäischen Datenbanken erstellt:
a) dem Geochemischen Atlas von Europa (http://weppi.gtk.fi/publ/foregsatlas/index.php), der vom Forum entwickelt wurde Europäische geologische Erhebungen (FOREGS); und
b) die geochemische Kartierung landwirtschaftlicher und beweideter Böden in Europa (GEMAS; http://gemas.geolba.ac.at/), ein Projekt, an dem Geochemie-Experten von EuroGeoSurveys und Eurometaux-Organisationen beteiligt sind.
Für die Daten wurde eine Normalverteilung angenommen und für das gewöhnliche Block Kriging wurde ein Semivariogramm (Variogramm)
für die Punkte verwendet. Die Daten für Tschechische Republik und Estland stammen aus den nationalen Datenbanken.
Abb. 3: Karte der Konzentration von Kaliumoxid (K2O) in Boden in Europa. Arithmetische Mittelwerte über 10 × 10 km Gitterzellen. Quelle: europa.eu
Keyword Suche bei Google
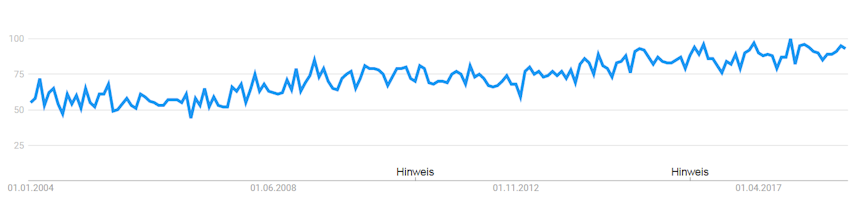
Wie ist das Interesse an dem Keyword Kalium im Netz? Hinweise dazu liefert die Google Trends Deutschland Abfrage (Abbildung 3)
Abb. 3: Anfragen zu “Kalium” bei Google Trends in Deutschland. Entwicklung von 2004 – 20018. Quelle: trends.google.de
Seit 2004 nimmt die Häufigkeit der Suche langsam aber stetig zu. Ein Grund könnte die Zunahme im Interesse an Nahrungsergänzungsprodukten oder allgemein aus dem Bereich Gesundheit sein.
Hypokaliämie ist bei COVID-19 häufig
Bei Patienten mit COVID-19 können mehrere Erkrankungen auftreten (z. B. Fieber, Hyperventilation, Anorexie, Gastroenteritis, Säure-Base-Störung), die zu Elektrolytstörungen führen können. Eine neue Studie eines italienischen Forscherteams, die im Juni 2020 auf medRxiv veröffentlicht wurde, berichtet, dass der Kaliumspiegel bei der COVID-19-Krankheit häufig niedrig ist, hauptsächlich aufgrund des Kaliumverlusts im Urin.
Sowohl die protean Manifestationen der Krankheit als auch die Nebenwirkungen der verwendeten Medikamente können zu einem Elektrolytungleichgewicht führen. Dementsprechend zeigt die aktuelle Studie, dass Hypokaliämie oder niedrige Kaliumspiegel im Blut ziemlich häufig auftreten. Dies ist ein besorgniserregendes Problem, da niedrige Kaliumspiegel unterhalb einer bestimmten Schwelle zu Anomalien des Herzrhythmus führen können, die manchmal tödlich sind.
Gründe sind unklar
Die genauen Gründe für die Entwicklung einer Hypokaliämie sind nicht klar, es wurden jedoch mehrere vorgeschlagen. Dazu gehören die Aktivierung des Renin-Angiotensin-Systems, der Verlust von Kalium durch den Darm, Appetitlosigkeit und schlechte Ernährung aufgrund der Infektion sowie Nierenschäden, möglicherweise aufgrund der direkten viralen Zytotoxizität auf tubulären Zellen.
Die aktuelle Studie konzentrierte sich auf die Beschreibung der Inzidenz, der Auswirkungen und des Mechanismus der Verursachung von Hypokaliämie bei hospitalisierten COVID-19-Patienten. Es wurden 1.671 Blutproben von 290 Patienten entnommen. Unter diesen hatten 171 normale Kaliumspiegel und wurden als Kontrollgruppe ausgewählt.
Bei 119 Patienten war ein niedriger Kaliumgehalt vorhanden, der 41% der Probe ausmachte. Die Serumkaliumspiegel lagen im Bereich von 2,4 mÄq / l bis 3,5 mÄq / l mit einem Mittelwert von 3,1 mÄq / l. Die meisten Patienten in dieser Gruppe hatten eine leichte Hypokaliämie (etwa 91%), die zusammen mit einer Hypokalzämie auftrat, und niedrigere durchschnittliche Magnesiumspiegel.
Auch bei einer Studie aus Wenzhou, China, wurde eine Hypokaliämie bei Covid-Patienten festgestellt.
Wissen
Mangel
Kalium ist ein essentielles Mineral, das viele wichtige Funktionen im menschlichen Organismus steuert, beispielsweise hilft es die, Muskelkontraktionen sowie zu regulieren, eine gesunde Nervenfunktion aufrechtzuerhalten und den Flüssigkeitshaushalt aufrecht zu erhalten. Ein Kaliummangel kann sich daher auf verschiedene Weise auswirken. Ein Mangel ist durch einen Kaliumspiegel im Blut von weniger als 3,5 mmol pro Liter gekennzeichnet.
Eine Mangelsituation kann beispielsweise auftreten, wenn der Körper plötzlich viel Flüssigkeit verliert, wie durch übermäßiges Schwitzen. Häufige Ursachen sind auch chronisches Erbrechen, Durchfall, und Blutverlust.
Anzeichen und Symptome eines Kaliummangels können sein:
Atembeschwerden
Ein schwerer Kaliummangel kann zu Atemschwierigkeiten führen. Dies ist darauf zurückzuführen, dass Kalium Signale unterstützt, die die Lungen dazu anregen, sich zusammenzuziehen und auszudehnen. Wenn der Kaliumspiegel im Blut sehr niedrig ist, können sich Ihre Lungen nicht richtig ausdehnen und kontrahieren. Dies führt zu Atemnot. Zu wenig Kalium im Blut kann zu Atemnot führen, da das Herz ungewöhnlich schlagen kann. Dies bedeutet, dass weniger Blut vom Herzen zum Rest des Körpers gepumpt wird. Blut liefert Sauerstoff an den Körper, daher kann ein veränderter Blutfluss zu Atemnot führen. Außerdem kann ein schwerer Kaliummangel die Funktion der Lunge stoppen, was tödlich ist.
Herzklopfen
Herzklopfen wird häufig mit Stress oder Angstzuständen in Verbindung gebracht, was jedoch auch ein Zeichen für Kaliummangel sein. Dies liegt daran, dass der Fluss von Kalium in und aus den Herzzellen dazu beiträgt, den Herzschlag zu regulieren. Niedrige Kaliumspiegel im Blut können diesen Fluss verändern und ein Pochen des Herzen verursachen. Darüber hinaus kann Herzklopfen ein Anzeichen für Herzrhythmusstörungen oder einen unregelmäßigen Herzschlag sein, der auch mit Kaliummangel zusammenhängt. Im Gegensatz zu Palpitationen wurde Arrhythmie mit schweren Herzerkrankungen in Verbindung gebracht.
Kribbeln und Taubheit
Personen mit Kaliummangel können anhaltende Kribbeln und Taubheitsgefühl verspüren. Dies wird als Parästhesie bezeichnet und tritt gewöhnlich in den Händen, Armen, Beinen und Füßen auf. Kalium ist wichtig für eine gesunde Nervenfunktion. Niedrige Kaliumspiegel im Blut können die Nervensignale schwächen und zu Kribbeln und Taubheit führen. Wenn diese Symptome gelegentlich harmlos sind, können anhaltendes Kribbeln und Taubheitsgefühle ein Anzeichen für eine zugrunde liegende Erkrankung sein.
Krämpfe
Muskelkrämpfe sind plötzliche, unkontrollierte Kontraktionen der Muskeln. Sie können auftreten, wenn der Kaliumspiegel im Blut niedrig ist. In den Muskelzellen hilft Kalium, Signale aus dem Gehirn weiterzuleiten, die die Kontraktionen anregen. Es hilft auch, diese Kontraktionen zu beenden, indem es sich aus den Muskelzellen herausbewegt. Wenn der Kaliumspiegel im Blut niedrig ist, kann das Gehirn diese Signale nicht so effektiv weiterleiten. Dies führt zu längeren Kontraktionen wie Muskelkrämpfen.
Kalium hilft Muskelkontraktionen zu starten und zu stoppen. Niedrige Kaliumspiegel im Blut können dieses Gleichgewicht beeinflussen und zu unkontrollierten und längeren Kontraktionen führen, die als Krämpfe bezeichnet werden.
Schwäche und Müdigkeit
Schwäche und Müdigkeit sind oft die ersten Anzeichen eines Kaliummangels. Dieser Mineralstoffmangel kann auf verschiedene Weise zu Schwäche und Ermüdung führen. Erstens hilft Kalium, Muskelkontraktionen zu regulieren. Wenn der Kaliumspiegel im Blut niedrig ist, erzeugen die Muskeln schwächere Kontraktionen. Ein Mangel an diesem Mineral kann auch die Art und Weise beeinflussen, wie der Körper Nährstoffe verwendet, was zu Ermüdung führt. Einige Untersuchungen weisen darauf hin, dass ein Mangel die Insulinproduktion beeinträchtigen kann, was zu hohen Blutzuckerspiegeln führen kann. Da Kalium hilft, Muskelkontraktionen zu regulieren, kann ein Mangel zu schwächeren Kontraktionen führen. Einige Beweise zeigen auch, dass ein Mangel den Körper im Umgang mit Nährstoffen wie Zucker beeinträchtigen kann, was zu Ermüdung und die Insulinproduktion beeinträchtigen kann (Rowe et al. 1980).
Verdauungsprobleme
Verdauungsprobleme haben viele Ursachen, eine davon kann Kaliummangel sein. Kalium hilft, Signale vom Gehirn an die Muskeln im Verdauungssystem weiterzuleiten. Diese Signale stimulieren Kontraktionen, die dem Verdauungssystem helfen, Nahrung zu produzieren, damit es verdaut werden kann.
Wenn der Kaliumspiegel im Blut niedrig ist, kann das Gehirn die Signale nicht so effektiv weiterleiten. Daher können Kontraktionen im Verdauungssystem schwächer werden und die Bewegung von Nahrungsmitteln verlangsamen. Dies kann Verdauungsprobleme wie Blähungen und Verstopfung verursachen.
Kaliummangel kann zu Problemen wie Völlegefühl und Verstopfung führen, da er die Bewegung von Nahrungsmitteln durch das Verdauungssystem verlangsamen kann.
Muskelschmerzen und Steifheit
Muskelschmerzen und Steifheit können auch ein Zeichen für einen schweren Kaliummangel sein. Diese Symptome können auf einen schnellen Muskelabbau hinweisen. Kaliumspiegel im Blut regulieren den Blutfluss in den Muskeln. Bei sehr niedrigen Spiegeln können sich die Blutgefäße zusammenziehen und die Durchblutung der Muskeln einschränken. Dies bedeutet, dass Muskelzellen weniger Sauerstoff erhalten, was dazu führen kann, dass sie platzen und auslaufen. Dies führt zu einer Rhabdomyolyse, die von Symptomen wie Muskelsteifheit und -schmerzen begleitet wird.
Wechselwirkungen mit Medikamenten
Verschiedene Arten von Medikamenten haben das Potenzial, den Kaliumstatus in einer Weise zu beeinflussen, die gefährlich sein könnte. Im Folgenden sind einige Beispiele aufgeführt. Personen, die diese und andere Medikamente einnehmen, sollten ihre Kaliumzufuhr und ihren Kaliumstatus mit ihren medizinischen Betreuern besprechen.
ACE-Hemmer und Angiotensin-Rezeptorblocker (ARBs)
ACE-Hemmer wie Benazepril (Lotensin®) und ARBs wie Losartan (Cozaar®) werden zur Behandlung von Bluthochdruck und Herzinsuffizienz, zur Verlangsamung des Fortschreitens der Nierenerkrankung bei Patienten mit chronischer Nierenerkrankung und Typ-2-Diabetes sowie zur Senkung der Morbidität und Mortalität nach Myokardinfarkt eingesetzt (Rebel 2012, Epstein 2009). Diese Medikamente reduzieren die Kaliumausscheidung im Urin, was zu Hyperkaliämie führen kann. Experten empfehlen die Überwachung des Kaliumstatus bei Personen, die ACE-Hemmer oder ARBs einnehmen, insbesondere wenn sie andere Risikofaktoren für eine Hyperkaliämie haben, wie z.B. eine eingeschränkte Nierenfunktion.
Kaliumsparende Diuretika
Kaliumschonende Diuretika wie Amilorid (Midamor®) und Spironolacton (Aldactone®) reduzieren die Ausscheidung von Kalium im Urin und können eine Hyperkaliämie verursachen. Experten empfehlen die Überwachung des Kaliumstatus bei Personen, die diese Medikamente einnehmen, insbesondere wenn sie eine beeinträchtigte Nierenfunktion oder andere Risikofaktoren für eine Hyperkaliämie aufweisen (Sarafidis et al. 2010).
Schleifen- und Thiaziddiuretika
Die Behandlung mit Schleifendiuretika, wie Furosemid (Lasix®) und Bumetanid (Bumex®), und Thiaziddiuretika, wie Chlorothiazid (Diuril®) und Metolazon (Zaroxolyn®), erhöht die Kaliumausscheidung im Urin und kann zu Hypokaliämie führen. Experten empfehlen, den Kaliumstatus bei Personen, die diese Medikamente einnehmen, zu überwachen und bei Bedarf eine Kalium-Supplementierung einzuleiten [78].
Kaliummangel bei Pflanzen
Auch bei Pflanzen tritt gelegentlich Kaliumdefizit auf. Der Mangel kann sich an braunen Rändern der Blätter zeigen. Bei Obstbäumen kann ein Kaliummangel zu kleineren Früchten führen.
Literatur
Boresch K., 1935: Gehalt der Pflanzen an Mineralstoffen. Tab. Biol. Per. 4: 485-522.
Bundesamt für Gesundheit BAG, Schweizerische Eidgenossenschaft: Umweltradioaktivität und Strahlendosen in der Schweiz, Jahresbericht 2017.
dge.de, 2017: Kalium - Schätzwerte für eine angemessene Zufuhr
Epstein M., 2009: Hyperkalemia as a constraint to therapy with combination renin-angiotensin system blockade: the elephant in the room. J Clin Hypertens (Greenwich);11:55-60. [PubMed abstract]
europa.eu: Europäische Komission, Radioactivity Environmental Monitoring (REMon): 2017: Potassium concentration in soil. European map of potassium in soil, March 20178
Kehayias J., J., Fiatarone M., Zhuang H., Roubenoff R., 1997: Total body potassium and fat: relevance to aging. Am J Clin Nutr.; 66: 904–10.
Lehrerfortbildungsservers Baden-Württemberg AB Natrium–Kalium-Pumpen
Lide D., R., 2004: CRC Handbook of Chemistry and Physics (85th ed.).
Natural Medicines. Potassium. 2017.
Raebel M., A., 2012: Hyperkalemia associated with use of angiotensin-converting enzyme inhibitors and angiotensin receptor blockers. Cardiovasc Ther 30:e156-66. [PubMed abstract]
Rowe J., W, Tobin J., D, Rosa R., M, Andres R., 1980: Effect of experimental potassium deficiency on glucose and insulin metabolism. Metabolism. 29:498 –502.
Reimann, C., Birke, M., Demetriades, A., Filzmoser, P. & O’Connor, P. (Editors), 2014.Chemistry of Europe’s agricultural soils - Part A: Methodology and interpretation of the GEMAS data set. Geologisches Jahrbuch (Reihe B 102), Schweizerbarth, Hannover, 528 pp.
Reimann, C., Birke, M., Demetriades, A., Filzmoser, P. & O’Connor, P. (Editors), 2014.Chemistry of Europe’s agricultural soils - Part B: General background information and further analysis of the GEMAS data set. Geologisches Jahrbuch (Reihe B 103), Schweizerbarth, Hannover, 352 pp.
Sarafidis PA., Georgianos PI., Lasaridis AN., 2010: Diuretics in clinical practice. Part II: electrolyte and acid-base disorders complicating diuretic therapy. Expert Opin Drug Saf;9:259-73. PubMed abstract
Schmalfuss K., 1936: Das Kalium. Eine Studie zum Kationenproblem im Stoffwechsel und bei der Ernährung der Pflanze. Naturwissenschaft und Landwirtschaft Heft 19.
Schmidt R. F., Thews G., 1995: Physiologie des Menschen.
Strohm D., Ellinger S., Leschik-Bonnet E., Maretzke F., Heseker H., German Nutrition Society (DGE), 2017: Revised Reference Values for Potassium Intake. Ann Nutr Metab.; 71 (1-2):118-124
Strasburger, E., 2008: Lehrbuch der Botanik. Gustav Fischer Verlag. Stuttgart. 36. Auflage
Wieser, M. E., (2006) - Atomic weights of the elements 2005 (IUPAC Technical Report), Pure and Applied Chemistry, 78 (11), pp. 2051–2066.
Ziegler, B., 2013: Kalium. Rhodt unter Rietburg (ehemaliger Spezialberater für Bodenpflege und Düngung der Abteilung Weinbau & Oenologie (Gruppe Weinbau), Dienstleistungszentrum Ländlicher Raum Rheinpfalz, Neustadt an der Weinstraße). Link